产品中心
深圳医疗器械生产企业管理者代表备案 指南针供
- 价格:请联系咨询
- 更新:2018-09-28
- 型号:0
- 品牌:深圳指南针财税
- 供应商:深圳指南针财务咨询有限公司
- 联系人:李冰
- 手机:15873170050
- 传真:0755-84828340
- Q Q:
- 地址:深圳市龙岗区坂田街道富豪花园荣兴大厦云族创客中心201-25号
详细信息
受理条件
(1)符合《广东省医疗器械生产管理者代表管理办法》的规定;
(2)企业有关人员无《医疗器械监督管理条例》第六十五条规定的5年内不得从事医疗器械生产经营活动的情形。
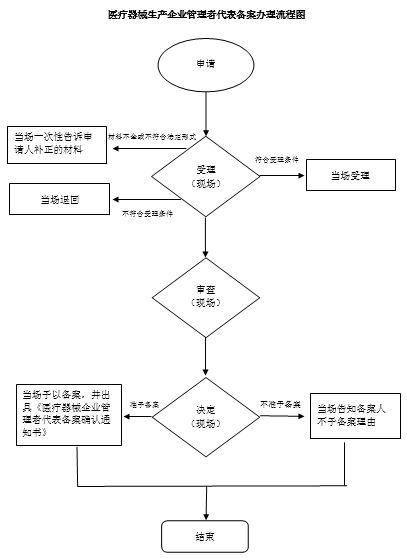
窗口办理流程
1.提交申请。申请人向深圳市食品药品监督管理局医械生产处提交申请,提交申请材料。
2.现场受理。企业提交纸质申请材料到深圳市食品药品监督管理局医械生产处,接件受理人员核验申请材料,当场作出受理决定。申请人符合申请资格,并材料齐全、格式规范、符合法定形式的,予以受理;申请人不符合申请资格或材料不齐全、不符合法定形式的,接件受理人员不予受理并退回材料。申请人材料不符合要求但可以当场更正的,退回当场更正后予以受理。发现材料需补正的,向申请人提出补正要求,申请人按要求补正后重新受理审查。
3.当场审查。受理后,审查人员对材料进行审查,当场作出审查决定。符合备案条件的,出具《医疗器械企业管理者代表备案确认通知书》;不予通过的,不予备案。
4.领取结果。申请人当场场领取《医疗器械企业管理者代表备案备案确认通知书》或《不予通过决定书》。

相关产品
免责声明:该信息由相关企业发布,商机B2B对此不对信息真伪提供担保。
风险防范建议:合作之前请先详细阅读本站防骗须知。商机B2B保留删除上述展示信息的权利;我们欢迎您举报不实信息,共同建立诚信网上环境。
风险防范建议:合作之前请先详细阅读本站防骗须知。商机B2B保留删除上述展示信息的权利;我们欢迎您举报不实信息,共同建立诚信网上环境。
